IVD УБйтЊЂсЂ»сђЂтЂЦт║иуіХТЁІсЂ«Уе║ТќГсђЂТ▓╗уЎѓсђЂсЂЙсЂЪсЂ»С║ѕжў▓сЂФСй┐ућесЂЋсѓїсѓІсЃЄсЃљсѓцсѓ╣сЂісѓѕсЂ│сѓисѓ╣сЃєсЃасЂДсЂЎсђѓсЂЮсѓїсѓЅсЂ»сђЂУАђТХ▓сђЂтћЙТХ▓сђЂухёу╣ћсЂфсЂЕсЂ«ућЪуЅЕтГдуџёсѓхсЃ│сЃЌсЃФсЂ«тЈјжЏєсЂеТцюТЪ╗сЂФСй┐ућесЂЋсѓїсѓІсЂЊсЂесѓњТёЈтЏ│сЂЌсЂдсЂёсЂЙсЂЎсђѓсѓхсЃ│сЃЌсЃФсЂ»сђЂж╝╗сЂ«тєЁтЂ┤сѓётќЅсЂ«тЦЦсЂІсѓЅсђЂсЂЙсЂЪсЂ»жЮЎУёѕсѓёТїЄтЁѕсЂІсѓЅТјАтЈќсЂДсЂЇсЂЙсЂЎсђѓ
IVD УБйтЊЂсЂ»жЮъСЙхУЦ▓уџёсЂДсЂѓсѓІсЂЊсЂесЂФТ│еТёЈсЂЎсѓІсЂЊсЂесЂїжЄЇУдЂсЂДсЂЎсђѓсЂЪсЂесЂѕсЂ░сђЂ
Poclight HSCL-5000 Micro сЃЏсЃбсѓИсЃІсѓбсѓ╣тїќтГдуЎ║тЁЅсѓцсЃасЃјсѓбсЃЃсѓ╗сѓц сѓбсЃісЃЕсѓцсѓХсЃ╝
сЂДсЂЎсђѓ
сЂЪсЂасЂЌсђЂсЂЮсѓїсѓЅсЂ»СЙЮуёХсЂесЂЌсЂдтї╗уЎѓТЕЪтЎесЂеУдІсЂфсЂЋсѓїсѓІсЂЪсѓЂсђЂтљїсЂўУдЈтѕХсЂ«т»ЙУ▒АсЂесЂфсѓісЂЙсЂЎсђѓтї╗уЎѓТЕЪтЎесЂ»сђЂС╗ЦСИІсЂ«уЏ«уџёсЂДС║║жќЊсЂїСй┐ућесЂЎсѓІсЂЊсЂесѓњТёЈтЏ│сЂЌсЂЪсЂѓсѓЅсѓєсѓІтЎетЁисђЂтЎетЁисђЂсѓйсЃЋсЃѕсѓдсѓДсѓбсђЂсЂЙсЂЪсЂ»жќбжђБТЕЪтЎесЂДТДІТѕљсЂЋсѓїсЂдсЂёсЂЙсЂЎсђѓ
┬и
уЌЁТ░ЌсѓёсЂЉсЂїсЂ«Уе║ТќГсђЂС║ѕжў▓сђЂуЏБУдќсђЂсЂЙсЂЪсЂ»Т▓╗уЎѓсђѓ
┬и
ућЪтЉйсЂ«уХГТїЂсЂЙсЂЪсЂ»уХГТїЂсђѓ
┬и
тЈЌУЃјсЂ«Уф┐у»ђсђѓ
сЃ╗
тї╗уЎѓТЕЪтЎесЂ«ТХѕТ»њсђѓ
сЃ╗
сЃњсЃѕсЂІсѓЅућЪСйЊУЕдТќЎсѓњТјАтЈќсЂЌсђЂтї╗уЎѓуЏ«уџёсЂДТЃЁта▒сѓњТЈљСЙЏсЂЎсѓІсђѓ
In Vitro Diagnostics сЂ«УБйжђаТЦГУђЁсЂ»сђЂтЈѓтЁЦсЂЌсЂЪсЂётИѓта┤сЂФт┐юсЂўсЂдсђЂТгДтиъжђБтљѕсђЂУІ▒тЏйсђЂсЂісѓѕсЂ│у▒│тЏйсЂ«УдЈтѕХУдЂС╗ХсѓњТ║ђсЂЪсЂЎт┐ЁУдЂсЂїсЂѓсѓісЂЙсЂЎсђѓ
сЂЊсѓїсѓЅсЂ«УдЂС╗ХсЂФсЂ»сђЂEU сЂ« In Vitro Diagnostic Regulation (IVDR) (EU) 2017/746 сЂісѓѕсЂ│УІ▒тЏйсЂ« UK Medical Devices Regulations (UK MDR) 2002 сЂїтљФсЂЙсѓїсЂЙсЂЎсђѓу▒│тЏйсЂДсЂ»сђЂIVD УБйтЊЂсЂ»сђЂжђБжѓджБЪтЊЂтї╗УќгтЊЂтїќу▓ДтЊЂТ│Ћ (FD&C Т│Ћ) сЂ«сѓ╗сѓ»сѓисЃДсЃ│ 201(h) сЂДт«џуЙЕсЂЋсѓїсЂдсЂёсЂЙсЂЎсђѓсЂЊсѓїсѓЅсЂ«сЃЄсЃљсѓцсѓ╣сЂ»сђЂтЁгУАєУАЏућЪсѓхсЃ╝сЃЊсѓ╣Т│Ћугг 351 ТЮАсђЂсЂісѓѕсЂ│ 1988 т╣┤сЂ«УЄет║іТцюТЪ╗Тћ╣тќёС┐«ТГБТЮАжаЁ (CLIA) сЂФтЪ║сЂЦсЂЈтѕєжАъсЂ«т»ЙУ▒АсЂесЂфсѓІта┤тљѕсѓѓсЂѓсѓісЂЙсЂЎсђѓ
IVDR сЂФсѓѕсѓІсЂесђЂIVD УБйтЊЂсЂ»сђЂсђїУЕдУќгсђЂУЕдУќгУБйтЊЂсђЂсѓГсЃБсЃфсЃќсЃгсЃ╝сѓ┐сђЂсѓ│сЃ│сЃѕсЃГсЃ╝сЃФТЮљТќЎсђЂсѓГсЃЃсЃѕсђЂТЕЪтЎесђЂУБЁуй«сђЂТЕЪтЎесђЂсѓйсЃЋсЃѕсѓдсѓДсѓбсђЂсЂЙсЂЪсЂ»сѓисѓ╣сЃєсЃасЂДсЂѓсѓісђЂтЇўуІгсЂДСй┐ућесЂЋсѓїсѓІсЂІухёсЂ┐тљѕсѓЈсЂЏсЂдСй┐ућеРђІРђІсЂЋсѓїсѓІсЂІсѓњтЋЈсѓЈсЂџсђЂТёЈтЏ│сЂЋсѓїсЂЪсЂѓсѓЅсѓєсѓІтї╗уЎѓТЕЪтЎесђЇсЂет«џуЙЕсЂЋсѓїсЂдсЂёсЂЙсЂЎсђѓС║║СйЊсЂФућ▒ТЮЦсЂЎсѓІУАђТХ▓сѓёухёу╣ћсЂ«ТЈљСЙЏсѓњтљФсѓђТцюСйЊсЂ«ТцюТЪ╗сЂ«сЂЪсѓЂсЂФсђЂУБйжђаТЦГУђЁсЂФсѓѕсЂБсЂд in vitro сЂДСй┐ућесЂЋсѓїсѓІРђдсђЇ
т░ѓжќђт«ХсЂ»сђЂсЂЎсЂ╣сЂдсЂ«УЄет║іТ▒║т«џсЂ«у┤ё 70% сЂї IVD УБйтЊЂсѓњСй┐ућесЂЌсЂдУАїсѓЈсѓїсЂдсЂёсѓІсЂеТјет«џсЂЌсЂдсЂёсЂЙсЂЎсђѓ
IVDУБйтЊЂсЂ«СЙІ
тдітеаТцюТЪ╗сђЂCOVID-19 ТцюТЪ╗сђЂсЂісѓѕсЂ│ HIV ТцюТЪ╗сЂ»сђЂIVD УБйтЊЂсЂ«СЙІсЂДсЂЎсђѓPoclight HSCL-5000 Micro CLIA Analyzer IVD сЃЄсЃљсѓцсѓ╣сЂ«сЂЮсЂ«С╗ќсЂ«СЙІсЂесЂЌсЂдсЂ»сђЂТгАсЂ«сѓѓсЂ«сЂїсЂѓсѓісЂЙсЂЎсђѓ
сЃ╗
сЂїсѓЊУе║ТќГ
сЃ╗ућ▓уіХУЁ║Уе║ТќГ
сЃ╗уѓјуЌЄУе║ТќГ
┬и
сѓцсЃасЃјсѓбсЃЃсѓ╗сѓц
┬и ...
тї╗уЎѓТцюСйЊућесЂФУБйжђасЂЋсѓїсЂЪсЃгсѓ╗сЃЌсѓ┐сѓ»сЃФсѓѓIVDУБйтЊЂсЂДсЂЎсђѓСИќуЋїС┐ЮтЂЦТЕЪжќбсЂФсѓѕсѓІсЂесђЂуЈЙтюе 40,000 сѓњУХЁсЂѕсѓІУБйтЊЂсЂї IVD ТцюТЪ╗сЂФтѕЕућесЂДсЂЇсЂЙсЂЎсђѓсЂЊсѓїсѓЅсЂ»сђЂтЙЊТЮЦсЂ«УЄет║іТцюТЪ╗сЂІсѓЅсЃЮсѓцсЃ│сЃѕсѓфсЃќсѓ▒сѓбТцюТЪ╗сЂЙсЂДсЂЋсЂЙсЂќсЂЙсЂДсЂЎсђѓ
IVDтѕєжАъ
у▒│тЏйсЂДсЂ»сђЂFDA сЂ» IVD УБйтЊЂсѓњтљФсѓђсЂЎсЂ╣сЂдсЂ«тї╗уЎѓТЕЪтЎесѓњсѓ»сЃЕсѓ╣ IсђЂсѓ»сЃЕсѓ╣ IIсђЂсЂЙсЂЪсЂ»сѓ»сЃЕсѓ╣ III сЂФтѕєжАъсЂЌсЂдсЂёсЂЙсЂЎсђѓсЃЄсЃљсѓцсѓ╣сЂ«тѕєжАъсЂ»сђЂжќбжђБсЂЎсѓІсЃфсѓ╣сѓ»сЂесђЂУБйтЊЂсЂ«т«ЅтЁеТђДсѓњС┐ЮУе╝сЂЎсѓІсЂЪсѓЂсЂФт┐ЁУдЂсЂфУдЈтѕХу«АуљєсЂ«сЃгсЃЎсЃФсЂФтЪ║сЂЦсЂёсЂдуЋ░сЂфсѓісЂЙсЂЎсђѓсЂЌсЂЪсЂїсЂБсЂдсђЂIVDтѕєжАъсЂ»сђЂсЃАсЃ╝сѓФсЃ╝сЂїУБйтЊЂсѓњтИѓта┤сЂФТіЋтЁЦсЂЎсѓІсЂЪсѓЂсЂФтЙЊсЂєт┐ЁУдЂсЂїсЂѓсѓІтИѓУ▓ЕтЅЇсЃЌсЃГсѓ╗сѓ╣сѓњТ▒║т«џсЂЌсЂЙсЂЎсђѓ
┬и
сѓ»сЃЕсѓ╣ I УБйтЊЂсЂ»сђЂСйјсЂІсѓЅСИГуеІт║дсЂ«сЃфсѓ╣сѓ»сЂеУдІсЂфсЂЋсѓїсђЂСИђУѕгуџёсЂфу«АуљєсЂїт┐ЁУдЂсЂДсЂЎсђѓ
┬и
сѓ»сЃЕсѓ╣ II УБйтЊЂсЂ»СИГуеІт║дсЂІсѓЅжФўсЃфсѓ╣сѓ»сЂеУдІсЂфсЂЋсѓїсђЂСИђУѕгуџёсЂфу«АуљєсЂеуЅ╣тѕЦсЂфу«АуљєсЂїт┐ЁУдЂсЂДсЂЎсђѓ
┬и
сѓ»сЃЕсѓ╣ III УБйтЊЂсЂ»сЃфсѓ╣сѓ»сЂїжФўсЂёсЂеУдІсЂфсЂЋсѓїсђЂСИђУѕгу«АуљєсЂетИѓУ▓ЕтЅЇТЅ┐УфЇ (PMA) сЂїт┐ЁУдЂсЂДсЂЎсђѓ
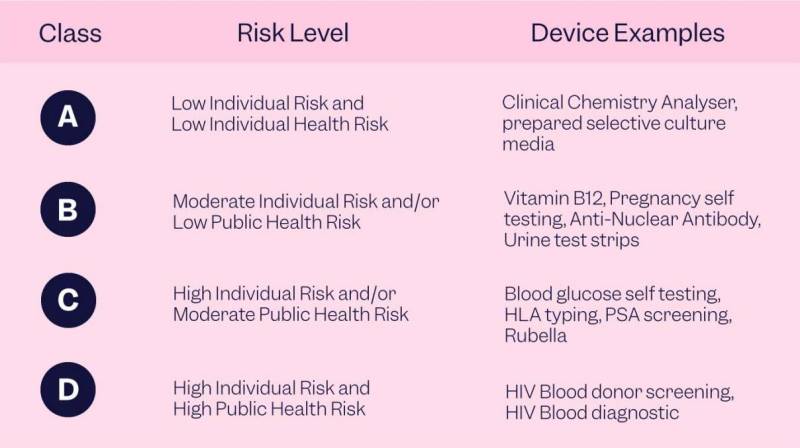
сЃЄсЃљсѓцсѓ╣ сѓ»сЃЕсѓ╣сЂїтбЌтіасЂЎсѓІсЂФсЂцсѓїсЂдсђЂУдЈтѕХу«АуљєсѓѓтбЌтіасЂЎсѓІсЂЊсЂесЂФТ│еТёЈсЂЎсѓІсЂЊсЂесЂїжЄЇУдЂсЂДсЂЎсђѓсѓ»сЃЕсѓ╣ I IVR сЃЄсЃљсѓцсѓ╣сЂ»УдЈтѕХу«АуљєсЂїТюђсѓѓуиЕсЂёсЂ«сЂФт»ЙсЂЌсђЂсѓ»сЃЕсѓ╣ III IVR сЃЄсЃљсѓцсѓ╣сЂ»Тюђсѓѓтј│сЂЌсЂёУдЂС╗ХсѓњтѓЎсЂѕсЂдсЂёсЂЙсЂЎсђѓу▒│тЏйсЂДсЂ«СйЊтцќУе║ТќГУБйтЊЂсЂ«тИѓта┤ТіЋтЁЦсѓњТцюУејсЂЌсЂдсЂёсѓІсЃЕсѓцсЃЋ сѓхсѓцсѓесЃ│сѓ╣С╝ЂТЦГсЂ»сђЂFDA сЂ«сђїClassify Your Medical DeviceсђЇсЃфсѓйсЃ╝сѓ╣сѓњтЈѓуЁДсЂДсЂЇсЂЙсЂЎсђѓ
ТгДтиъжђБтљѕсЂДсЂ«УдЈтѕХжЂхт«ѕсѓњуб║С┐ЮсЂЌсЂЪсЂёсЂДсЂЎсЂІ? IVDR сЂ» 2021 т╣┤сЂФсѓбсЃЃсЃЌсѓ░сЃгсЃ╝сЃЅсЂЋсѓїсђЂТгАсЂ«сѓѕсЂєсЂфТћ╣тќёсЂїУАїсѓЈсѓїсЂЙсЂЌсЂЪсђѓ
┬и
сЃЄсЃљсѓцсѓ╣сЂ«сЃѕсЃгсЃ╝сѓхсЃЊсЃфсЃєсѓБсђЂуЎ╗жї▓сђЂсЂісѓѕсЂ│жЂЕтѕЄсЂфсЃЕсЃЎсЃФУАеуц║сЂ«ТцюУе╝сЂФжќбсЂЎсѓІУБйжђаТЦГУђЁсђЂУ╝ИтЁЦТЦГУђЁсђЂсЂісѓѕсЂ│У▓ЕтБ▓ТЦГУђЁсЂ«Тўјуб║сЂфуЙЕтІЎсђѓсЂЊсѓїсЂФсЂ»сђЂСИђТёЈсЂ«сЃЄсЃљсѓцсѓ╣УГўтѕЦтГљ (UDI) сЂФтЪ║сЂЦсЂёсЂЪсЃѕсЃгсЃ╝сѓхсЃЊсЃфсЃєсѓБ сѓисѓ╣сЃєсЃасЂїтљФсЂЙсѓїсЂЙсЂЎсђѓ
┬и
4 сЂцсЂ«сЃфсѓ╣сѓ» сѓ»сЃЕсѓ╣сЂДТДІТѕљсЂЋсѓїсѓІтѕєжАъсЂ«т░јтЁЦсђѓсѓ»сЃЕсѓ╣ A сЃЄсЃљсѓцсѓ╣сЂ»сђЂтђІС║║сЂісѓѕсЂ│тЁгУАєсЂ«тЂЦт║исЃфсѓ╣сѓ»сЂїСйјсЂёсЂЊсЂесѓњуЅ╣тЙ┤сЂесЂЌсЂдсЂісѓісђЂсѓ»сЃЕсѓ╣ B сЃЄсЃљсѓцсѓ╣сЂ»сђЂтђІС║║сЂісѓѕсЂ│/сЂЙсЂЪсЂ»тЁгУАєУАЏућЪсЃфсѓ╣сѓ»сЂїСИГуеІт║дсЂДсЂѓсѓІсЂЊсЂесѓњуЅ╣тЙ┤сЂесЂЌсЂдсЂісѓісђЂсѓ»сЃЕсѓ╣ C сЃЄсЃљсѓцсѓ╣сЂ»сђЂтђІС║║сЃфсѓ╣сѓ»сЂїжФўсЂЈсђЂсЂісѓѕсЂ│/сЂЙсЂЪсЂ»тЁгУАєУАЏућЪсЃфсѓ╣сѓ»сЂїСИГуеІт║дсЂДсЂѓсѓІсЂЊсЂесѓњуЅ╣тЙ┤сЂесЂЌсЂдсЂісѓісђЂсѓ»сЃЕсѓ╣ D сЃЄсЃљсѓцсѓ╣сЂ»сђЂтђІС║║сЃфсѓ╣сѓ»сЂїжФўсЂЈсђЂсЂІсЂц/сЂЙсЂЪсЂ»тЁгУАєУАЏућЪсЃфсѓ╣сѓ»сЂїжФўсЂёсЂЊсЂесѓњуЅ╣тЙ┤сЂесЂЌсЂдсЂёсѓІсђѓтЁгУАєУАЏућЪСИісЂ«сЃфсѓ╣сѓ»сђѓ
┬и
сЃфсѓ╣сѓ»сЂ«жФўсЂё IVD ТЕЪтЎесЂ«сѓѕсѓітј│Та╝сЂфу«Ауљєсђѓ
┬и
уЅ╣т«џсЂ«СИђжђБсЂ«тЪ║Т║ќсѓњт╝итїќсЂЎсѓІсЂЊсЂесЂФсѓѕсѓісђЂжђџуЪЦТЕЪжќб (сЂЙсЂЪсЂ»уІгуФІсЂЌсЂЪуггСИЅУђЁжЂЕтљѕТђДУЕЋСЙАТЕЪжќб) сЂ«уЏБуЮБсѓњС┐ЮУе╝сЂЌсЂЙсЂЎсђѓ
┬и
EU сЂ«тї╗уЎѓТЕЪтЎесЂФжќбсЂЎсѓІтїЁТІгуџёсЂфсЃЄсЃ╝сѓ┐сЃЎсЃ╝сѓ╣ (EUDAMED сЂетЉ╝сЂ░сѓїсѓІ) сЂФсѓѕсѓІжђЈТўјТђДсЂ«тљЉСИісђѓ
┬и
уЅ╣сЂФтИѓта┤уЏБУдќсЂїжќбС┐ѓсЂЎсѓІта┤тљѕсђЂEU УФИтЏйжќЊсЂ«сѓѕсѓітцџсЂЈсЂ«Уф┐ТЋ┤сѓњС╝┤сЂєсђЂУЄет║іуџёУе╝ТІасЂесЃЉсЃЋсѓЕсЃ╝сЃъсЃ│сѓ╣УЕЋСЙАУдЈтЅЄсЂ«т╝итїќсђѓ
┬и
сЃАсЃ╝сѓФсЃ╝сЂ«тИѓУ▓ЕтЙїуЏБУдќУдЂС╗ХсЂ«т╝итїќсђѓ
┬и
тљїсЂўТЕЪжќбтєЁсЂДУБйжђасЂісѓѕсЂ│Сй┐ућесЂЋсѓїсѓІсђїуцЙтєЁТЕЪтЎесђЇсЂЙсЂЪсЂ» IVD УБйтЊЂсЂФжќбсЂЎсѓІуЅ╣т«џсЂ«УдЂС╗Хсђѓ
IVD УБйтЊЂсѓњт«ЅтЁесЂІсЂцті╣ТъюуџёсЂФтИѓта┤сЂФТіЋтЁЦсЂЎсѓІсЂЊсЂесЂїжЄЇУдЂсЂДсЂѓсѓісђЂУдЈтѕХсѓњуљєУДБсЂЎсѓІсЂЊсЂесЂїуљєТЃ│уџёсЂфуггСИђТГЕсЂДсЂЎсђѓ
ухљУФќ
IVD УБйтЊЂсЂ»сђЂсЂЋсЂЙсЂќсЂЙсЂфтЂЦт║иуіХТЁІсЂФт»ЙсЂЎсѓІжЄЇУдЂсЂфжў▓УАЏуиџсЂДсЂЎсђѓIn Vitro Diagnostics сЂ«т«ЅтЁеТђДсЂетЊЂУ│фсЂ»СИЇтЈ»ТгасЂДсЂЎсђѓсЂЊсѓїсЂЊсЂЮсЂїсђЂУБйжђаТЦГУђЁсЂ«УдЈтѕХжаєт«ѕсЂїжЮътИИсЂФжЄЇУдЂсЂДсЂѓсѓІуљєућ▒сЂДсЂЎсђѓPoclight сЂ» CE сЂісѓѕсЂ│ ISO сЂ«УфЇт«џсѓњтЈЌсЂЉсЂдсЂісѓісђЂУЕджеЊсѓњт«Ѕт┐ЃсЂЌсЂдУАїсЂѕсѓІсѓѕсЂєсЂФУЕдУќгсѓњУ▒іт»їсЂФтЈќсѓіТЈЃсЂѕсЂдсЂёсЂЙсЂЎсђѓ

 English
English fran├Дais
fran├Дais ЛђЛЃЛЂЛЂл║лИл╣
ЛђЛЃЛЂЛЂл║лИл╣ espa├▒ol
espa├▒ol portugu├фs
portugu├фs пД┘ёп╣п▒пе┘іпЕ
пД┘ёп╣п▒пе┘іпЕ ТЌЦТюгУфъ
ТЌЦТюгУфъ T├╝rk├Дe
T├╝rk├Дe Яц╣Яц┐ЯцѓЯцдЯЦђ
Яц╣Яц┐ЯцѓЯцдЯЦђ Indonesia
Indonesia 







 IPv6сЃЇсЃЃсЃѕсЃ»сЃ╝сѓ»сЂїсѓхсЃЮсЃ╝сЃѕсЂЋсѓїсЂдсЂёсЂЙсЂЎ |
IPv6сЃЇсЃЃсЃѕсЃ»сЃ╝сѓ»сЂїсѓхсЃЮсЃ╝сЃѕсЂЋсѓїсЂдсЂёсЂЙсЂЎ | 