дљУе§Ци®ЇжЦ≠詶иЦђгБЃеЃЙеЃЪжАІгБ®гБѓгАБдљУе§Ци®ЇжЦ≠зФ®еМїзЩВж©ЯеЩ®гБМгБЭгБЃжАІиГљзЙєжАІгВТгГ°гГЉгВЂгГЉгБМжМЗеЃЪгБЧгБЯеИґйЩРеЖЕгБЂзґ≠жМБгБІгБНгВЛиГљеКЫгВТжМЗгБЧгАБ
гБЂењЬгБШгБ¶жИРйХЈгБЩгВЛи£љеУБгБЃиГљеКЫгВТеПНжШ†гБЧгБ¶гБДгБЊгБЩгАВ
дљУе§Ци®ЇжЦ≠зԮ詶иЦђгБѓгАБдњЭзЃ°гАБиЉЄйАБгАБдљњзФ®гБЃйБОз®ЛгБЂгБКгБДгБ¶гАБжЄ©еЇ¶гАБжєњеЇ¶гАБеЕЙгАБеЗНзµРиЮНиІ£гБЃзє∞гВКињФгБЧгАБйЦЛж†УгАБжМѓеЛХгБ™гБ©гБЃгБХгБЊгБЦгБЊгБ™ељ±йЯњи¶БеЫ†гБЂгВИгВКгАБи£љеУБгБЃеЃЙеЃЪжАІгБЂељ±йЯњгВТдЄОгБИгВЛеПѓиГљжАІгБМгБВгВКгБЊгБЩгАВеЃЙеЃЪжАІи©¶й®УжЬЯйЦУгБѓдЄАиИђгБЂйХЈгБПпЉИ6пљЮ24гГґжЬИпЉЙгАБз†Фз©ґи®≠и®ИгБЃйЦЛеІЛжЩВгБЂи£љеУБиЗ™дљУгБЃзЙєжАІгВТеНБеИЖгБЂиАГжЕЃгБЧгАБз†Фз©ґжЭ°дїґгВТжЬАйБ©и®≠и®ИгБЩгВЛгБУгБ®гБІжЩВйЦУгБЃзД°йІДгВТйБњгБСгАБз†Фз©ґйЦЛзЩЇгВ≥гВєгГИгВТеЙКжЄЫгБІгБНгБЊгБЩгАВдЉБж•≠
дљУе§Ци®ЇжЦ≠гБКгВИгБ≥еЃЙеЃЪжАІз†Фз©ґгБЂгБКгБДгБ¶гВИгБПгБВгВЛи≥™еХПгБѓжђ°гБЃгБ®гБКгВКгБІгБЩгАВ
√£√£1.дњЭзЃ°жЭ°дїґгБЂгБѓжЬАжВ™гБЃзКґжЕЛгБѓеРЂгБЊгВМгБЊгБЫгВУгАВдЄАйГ®гБЃдЉБж•≠гБѓеєЕеЇГгБДжЄ©еЇ¶жЭ°дїґгВТи®≠еЃЪгБЧгБ¶гБДгБЊгБЩгБМгАБжЬАжВ™гБЃжЭ°дїґгВТж§Ьи®ЉгБЧгБ¶гБДгБЊгБЫгВУгАВгГ°гГЉгВЂгГЉгБМ 10 пљЮ 30¬∞C гБ™гБ©гБЃзЙєеЃЪгБЃжЄ©еЇ¶зѓДеЫ≤гВТжШО祯гБЂи®ШиЉЙгБЩгВЛењЕи¶БгБМгБВгВЛе†іеРИгБѓгАБз†Фз©ґгГЧгГ≠гВїгВєгБЂ 30¬∞C гБІгБЃйХЈжЬЯз†Фз©ґгВТеРЂгВБгВЛењЕи¶БгБМгБВгВКгБЊгБЩгАВ
√£√£2.з†Фз©ґжЩВйЦУгБМдЄНеНБеИЖгБІгБЩгАВгВ≥гВєгГИеЙКжЄЫгБЃиАГжЕЃгБЊгБЯгБѓи®≠и®ИдЄКгБЃеХПй°МгБЂгВИгВКгАБдЄАйГ®гБЃдЉБж•≠гБѓгАБT0 (йЦЛеІЛзВє) гБІи™њжЯїгВТеЃЯжЦљгБЧгБ¶гБДгБ™гБДгАБдЄ≠йЦУжЩВзВєгБМе∞СгБ™гБЩгБОгВЛгАБдЄїеЉµгБХгВМгБ¶гБДгВЛжЬЙеКєжЬЯйЦУеЊМгБЃжЩВзВєгВТгВЂгГРгГЉгБЧгБ¶гБДгБ™гБДгБ™гБ©гБЃеХПй°МгВТжК±гБИгБ¶гБДгБЊгБЩгАВйЦЛеІЛжЩВеИїгБѓи£љеУБгБЃи£љйА†жЩВеИїгБЂеПѓиГљгБ™йЩРгВКињСгБ•гБСгВЛењЕи¶БгБМгБВгВКгАБгБЭгБЃеЊМгБЃз†Фз©ґзµРжЮЬгБ®гБЃжѓФиЉГгВТеЃєжШУгБЂгБЩгВЛгБЯгВБгБЂеЯЇз§ОгГЗгГЉгВњгВТдњЭжМБгБЩгВЛењЕи¶БгБМгБВгВЛгБУгБ®гБЂж≥®жДПгБЧгБ¶гБПгБ†гБХгБДгАВдЄ≠йЦУжЩВзВєгБЃи®≠еЃЪгВТеҐЧгВДгБЧгАБгВИгВКе§ЪгБПгБЃгГЗгГЉгВњ гГЭгВ§гГ≥гГИгВТеПОйЫЖгБЩгВЛгБ®гАБгГЗгГЉгВњ гГЙгГ™гГХгГИгВТжЧ©жЬЯгБЂзЙєеЃЪгБЩгВЛгБЃгБЂељєзЂЛгБ°гБЊгБЩгАВдЄН祯еЃЯжАІгБЃдљЩеЬ∞гВТиАГжЕЃгБЧгБ¶гАБдЇИжГ≥гБХгВМгВЛе£∞жШОгБЃеЊМгБЂйБ©еИЗгБ™жЬЯйЦУгВТгВЂгГРгГЉгБЧгБЊгБЩгАВ
√£√£3.з†Фз©ґзµРжЮЬгБѓдЄНжШОгБІгБВгВЛгАВзµРжЮЬгБЃгБВгБДгБЊгБДгБХгБѓгАБз≤ЊеЇ¶гГ™гГХгВ°гГђгГ≥гВєгБЃ CV и¶БдїґгВДеУБи≥™зЃ°зРЖгБЃгГЗгГЉгВњгГРгВ§гВҐгВєгБЃи®±еЃєгГђгГЩгГЂгБ™гБ©гБЃи®±еЃєеЯЇжЇЦгБЃгБВгБДгБЊгБДгБХгБЂиµЈеЫ†гБЧгБЊгБЩгАВгГ°гГЉгВЂгГЉгБѓгАБеЕГгБЃи©¶й®УеА§гБ®жШО祯гБ™еРИж†ЉеЯЇжЇЦгБЂеЯЇгБ•гБДгБ¶гАБгГЗгГЉгВњеЗ¶зРЖгГЧгГ≠гВїгВєгВТжШО祯гБЂгБЧгАБи£љеУБгБЃеУБи≥™е§ЙеМЦгБЃеВЊеРСгВТи°®гВДгВ∞гГ©гГХгБЃељҐеЉПгБІи°®з§ЇгБЧгАБзµРжЮЬгБЃеИЖжЮРгБЂеЯЇгБ•гБДгБ¶жЬЙеКєжАІгБЃдЄїеЉµгВТж±ЇеЃЪгБЩгВЛењЕи¶БгБМгБВгВКгБЊгБЩгАВ
з†Фз©ґгБЃзµРжЮЬгБѓгАБеЃ£и®АгБХгВМгБЯи£љеУБгБМгАБдЄїеЉµгБХгВМгБЯдњЭзЃ°жЭ°дїґгБКгВИгБ≥жЬЯйЦУгБЃдЄЛгБІеЃЙеЃЪжАІи¶БдїґгВТжЇАгБЯгБЩгБУгБ®гБМгБІгБНгВЛгБУгБ®гВТеЃЯи®ЉгБЩгВЛењЕи¶БгБМгБВгВКгБЊгБЩгАВз†Фз©ґгГЗгГЉгВњгВДеЃЙеЃЪжАІгБЂйЦҐгБЩгВЛи°®з§ЇгБІгБѓгАБгАМ2пљЮ8вДГгБІдњЭе≠ШгАНгБ™гБ©гАБеЕЈдљУзЪДгБ™дњЭе≠ШжЭ°дїґгБЃзѓДеЫ≤гВТжШО祯гБЂгБЩгВЛењЕи¶БгБМгБВгВКгАБгАМеЖЈиФµгАНгАБгАМеЖЈеЗНгАНгАБгАМеЃ§еЖЕгАНгБ™гБ©гБЃдЄН祯еЃЯгБ™и®АиСЙгВТдљњзФ®гБЩгВЛгБУгБ®гБѓгБКеЛІгВБгБІгБНгБЊгБЫгВУгАВ гАМжЄ©еЇ¶гАНгВТдљњзФ®гБЧгБ¶дњЭзЃ°жЄ©еЇ¶гВТи™ђжШОгБЧгБЊгБЩгАВ
Poclight Biotech гБЂгВИгБ£гБ¶и£љйА†гБХгВМгБЯ詶иЦђгБѓгАБгВ§гГ†гГОгВҐгГГгВїгВ§и£љеУБгАБгГЧгГ©гГГгГИгГХгВ©гГЉгГ†гАБгБКгВИгБ≥гВµгГЉгГУгВєгВТжПРдЊЫгБЧгБ¶гБДгБЊгБЩгАВгБЭгБЧгБ¶ж§ЬжЯїгВ≠гГГгГИ дљњзФ®жЩВгВДиЉЄйАБжЩВгБЂеЃЙеЃЪгБЧгБ¶гБДгБЊгБЩгАВжЬАе§ІгБЃеИ©зВєгБѓгАБгВ≥гГЉгГЂгГЙ гГБгВІгГЉгГ≥гБМењЕи¶БгБ™гБДгБУгБ®гБІгБЩгАВгБУгВМгБЂгВИгВКгАБй°ІеЃҐгБЃгВ≥гВєгГИгБМе§ІеєЕгБЂеЙКжЄЫгБХгВМгАБCLIA гВ≠гГГгГИгБЃж§Ьи®ЉгБ®еУБи≥™гГЖгВєгГИгБМеїґйХЈгБХгВМгБЊгБЩгАВ 1еЫЮеИЖгБЪгБ§еАЛеМЕи£ЕгБХгВМгБ¶гБДгВЛгБЃгБІдљњгБДгВДгБЩгБПгАБзД°йІДгБМгБВгВКгБЊгБЫгВУгАВ
еЗНзµРдєЊзЗ•гГУгГЉг¯詶иЦђгБѓгВµгГ≥гГЧгГЂжЈїеК†еЊМгБЩгБРгБЂжЇґиІ£гБЧгБ¶еЭЗдЄАгБ™еПНењЬгВТеЃЯзПЊгБЧгАБжЬАеИЭгБЃгВµгГ≥гГЧгГЂгБЂгБЛгБЛгВЛжЩВйЦУгБѓгВПгБЪгБЛ 3 еИЖгБІгБЩгАВж≠£зҐЇгБЛгБ§ињЕйАЯгБ™еЕНзЦЂжЄђеЃЪж≥ХињЕйАЯгГЖгВєгГИгАВгБУгВМгБЂгБѓгАБйЂШз≤ЊеЇ¶гАБеД™гВМгБЯеЖНзПЊжАІгБЃгГЖгВєгГИ гВ≠гГГгГИгАБдљОгВ≥гВєгГИгАБйЂШйАЯгАБз∞°еНШгБЂдњЭзЃ°гБІгБНгВЛгБ®гБДгБЖеИ©зВєгБМгБВгВКгБЊгБЩгАВ
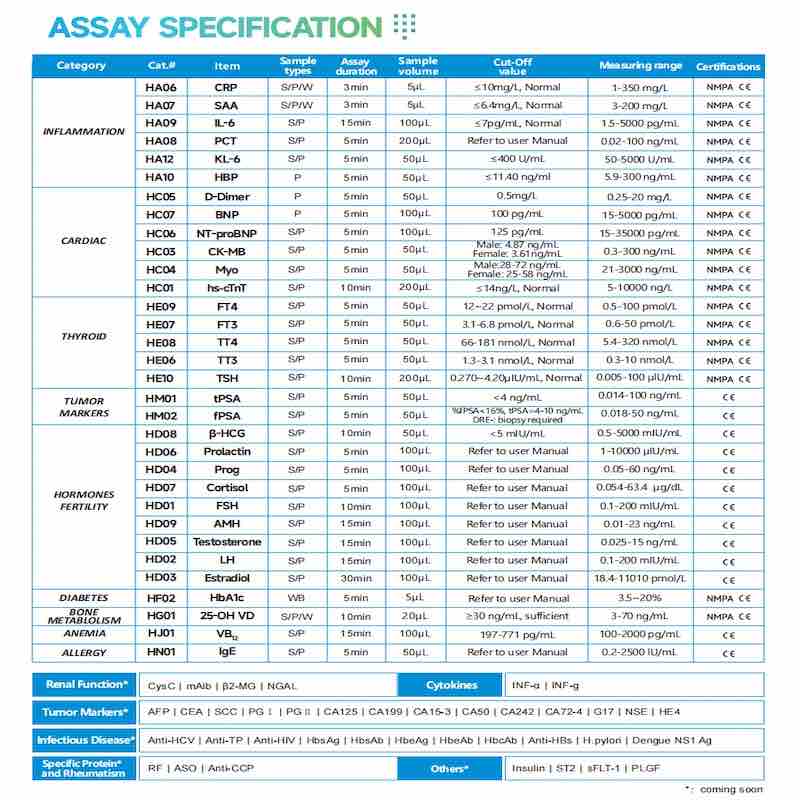
ж§ЬжЯїй†ЕзЫЃгБѓгАБзВОзЧЗгАБдї£иђЭгАБзФ≤зКґиЕЇгГЫгГЂгГҐгГ≥гАБгВµгВ§гГИгВЂгВ§гГ≥гАБCDеЫ†е≠РгАБењГз≠ЛгБ™гБ©гБЃеИЖйЗОгВТгВЂгГРгГЉгБЧгБ¶гБКгВКгАБж§ЬжЯїйГ®йЦАгАБжХСжА•йГ®йЦАгАБжХСжА•гВїгГ≥гВњгГЉгАБиЗ®еЇКйГ®йЦАгАБICUгАБеИЭз≠ЙзЧЕйЩҐгАБзђђдЄЙиАЕж§ЬжЯїж©ЯйЦҐгАБиЇЂдљУж§ЬжЯїгВїгГ≥гВњгГЉгБ™гБ©

 English
English fran√Іais
fran√Іais —А—Г—Б—Б–Ї–Є–є
—А—Г—Б—Б–Ї–Є–є espa√±ol
español português
portugu√™s ЎІўДЎєЎ±Ў®ўКЎ©
ЎІўДЎєЎ±Ў®ўКЎ© жЧ•жЬђи™Ю
жЧ•жЬђи™Ю T√Љrk√Іe
T√Љrk√Іe а§єа§ња§В৶а•А
а§єа§ња§В৶а•А Indonesia
Indonesia 







 IPv6гГНгГГгГИгГѓгГЉгВѓгБМгВµгГЭгГЉгГИгБХгВМгБ¶гБДгБЊгБЩ |
IPv6гГНгГГгГИгГѓгГЉгВѓгБМгВµгГЭгГЉгГИгБХгВМгБ¶гБДгБЊгБЩ | 